1. The first target에 대한 가설
○ 표제는 루게릭병을 정의하는 운동신경 퇴화에 대한 원인이 어디서부터 출발하고 약물 개발의 그 첫 번째 표적인 ‘the first target’에 대한 MOA(mode of action, 작용기전)을 확인하는 과정이라고 할 수 있다.
○ 루게릭 즉 ALS는 ‘ Inexplicable(설명-불가능한) ’multifactorial(다요인), multigenic(다유전자형), 그리고 multiorgan(다기관) disease‘으로 규정되어 ’the first target으로 규정하기는 어렵다. 그러나 퇴행성질환 및 노화의 촉진과 인과관계가 가장 중요한 요인으로 생체 내 pro-oxidant의 증가 또는 anti-oxidant의 감소로 산화-항산화의 균형이 깨지는 산화적 스트레스(oxidative stress)에 기인하는 것으로 가설을 설정하였다. 이에 본 칼럼에서는 ’multifactorial(다요인), multigenic(다유전자형), 그리고 multiorgan(다기관)에 대한 고려가 없이 ALS는 근육세포의 미토콘드리아에서 uncoupling reaction 등에 의한 ROS(reactive oxygen species)에 기인하며 이에 의한 영향으로 운동신경의 퇴화 및 ALS가 유도된다는 것이 기본적인 가설이다.
○ 비록 가설을 설정하였지만 ALS disease-modifying drug으로 현존하는 약물과 산화적 스트레스에 대한 영향을 확인할 필요성이 있다. 또한 본 칼럼에서는 가설-기반 ALS disease-modifying drug을 개발에 있어서 현존하는 약물의 특성, 그리고 산화적 스트레스와의 연관성을 확인하는 것이 목적이다.
2. 현존 ALS disease-modifying drug: Riluzole와 Edaravone
1) 두 약물의 개발 과정
○ 현존하는 ALS 약물인 Riluzole와 Edaravone 등 2가지이며 이들은 치료제가 아니라 진행을 늦추는 완화제 또는 기능을 다소 증진시키는 조절제인 disease-modifying drug이다. Riluzole(리루졸)은 1980년대 후반 뇌졸중 치료제로 개발되었으나 FDA 승인에 실패하여(Rothstein 등, 2017) 이미 나와 있는 약을 새로운 질환에 적용하여 약물을 개발하는 방법인 Drug repositioning을 통해 ALS로 전환하여 개발되었다. FDA로 1995년에 ALS로 승인받기 전까지 수 차례 걸쳐 임상시험에서 실패 경험이 가지고 있다. 이후 ALS 치료제 개발을 위해 anti-glutaminergic(항글루타민 작동성), anti-inflammatory(항염증성), anti-oxidative(항산화적), neuroprotective(신경보호성), neurotrophic(신경영양성) 물질을 비롯하여 colony-stimulating factor 1R inhibitors(집락자극인자 1R 저해제) 등의 약 60 여종이 시도되었으나 모두 성공되지 못했다(Petrov 등, 2017). 이후 2001년에 edaravone(에다라본)이 뇌졸중 치료제로 일본에서 승인되었고(Rothstein 등, 2017), 2011년 ALS 임상시험을 통해 2015년에 일본, 그리고 2017년에 미국 등에서 ALS 치료제로 승인받았다.
2) 구조와 두 물질의 임상시험-PK 특성 요약
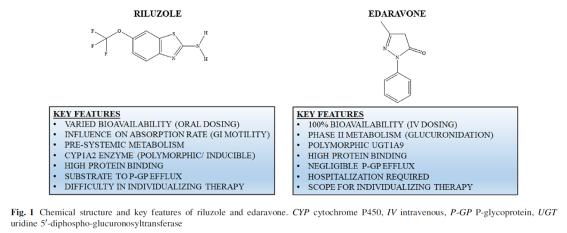
(Dash 등, 2018)
① Riluzole의 임상시험-PK 분석
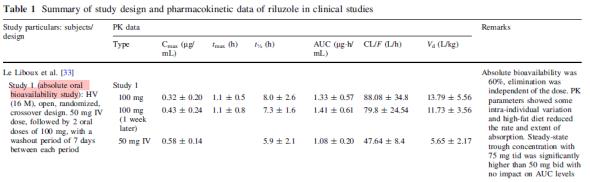
○ Table 1은 Riluzole 경구 투여의 임상시험을 통해 확보된 인체 PK 자료이다(Le Liboux 등, 1997). 건강한 남자 16명을 대상으로 PK 여구 결과, 생체이용률(bioavailibility)은 약 60%, Tmax는 1-1.5 시간, 분포는 비교적 좋은 3.4L/kg, 혈장 단백질에 약 96%가 결합하여 이동하는 것으로 조사되었다. 간에서는 CYP1A2, 그리고 간 외조직에서는 CYP1A1 등에 의해 biotransformation의 제1상반응으로 이루어지며 제2상반응은 glucuronoconjugation에 이루어져 친전자성대사체 로 전환은 없는 것으로 추정된다.
② Edravone의 임상시험-PK 분석
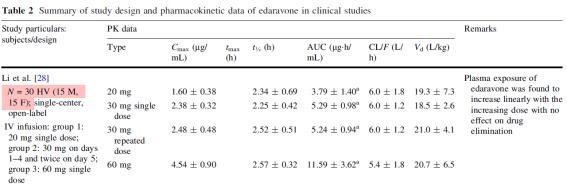
○ Table 2는 Edaravone의 정맥 투여의 임상시험을 통해 확보된 인체 PK 자료로 건강한 남녀 가각 15명이 대상으로 얻어진 자료이다(Li 등, 2012). 피시험자에게 20 mg/kg의 단회투여 시 Cmax는 1.6 μg/mL 그리고 반감기는 2시간 30분 정도로 조사되었으며 분포는 아주 높은 20L/kg과 92% 정도가 혈장단백질과 결합한 상태로 확인되었다. 제1상반응과 제2상반응으로 구성된 BIotransformation(생화학적 전환)에서 Edaravone은 제상반응의 glucuronide conjugation을 통해 친수성으로 전환되어 배출되는 것으로 확인되었다. 이는 Edaravone이 제1상반응이 없이 가수분해를 통해 극성을 띠게 되면 당에 의해 포합되어 배출되는 것으로 추정된다.
3. Riluzole과 Edaravone의 MOA
1) Riluzole의 ALS에 대한 MOA
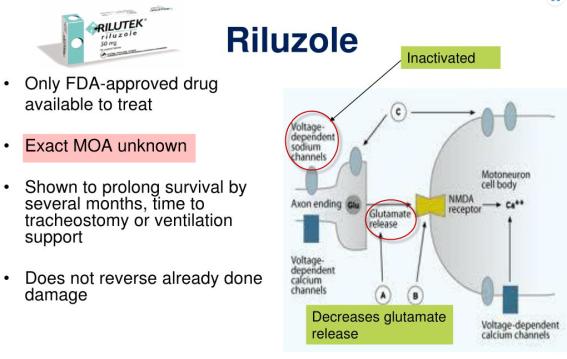
○ Riluzole의 ALS에 대한 MOA에 대한 것은 잘 알려지지 않았지만, 아래의 <그림>에서처럼 ① Voltage-dependent sodium channels 차단, ② Glutamate 방출 감소, ③ 운동신경세포에서 N-methyl-D-aspartate (NMDA) receptors 등과 같은 막수용체에 신경전달물질의 결합하는 세포내 이벤트를 방해 등으로 추정된다(Doble,1996). 그러나 상해를 입은 신경세포 자체를 원상태로 회복기능은 불가능하다.
2) Edaravone의 ALS에 대한 MOA
○ Edaravone의 ALS에 대한 MOA 기전은 ferroptosis로 요약할 수 있다. 다양한 이유로 세포가 죽는데 이러한 세포죽음은 세포괴사(necrosis), 세포괴사-사멸(necroptosis), 세포사멸(apoptosis) 그리고 자가포식(autophagy, 자기소화작용) 등이 있다(우선민 등, 2017; Hosohata 등, 2022). Ferroptosis(페롭토시스)는 최근에 발견된 세포사멸(cell death)의 한 종류로 철-의존성 세포사멸(apoptosis)이다. 즉, 페롭토시스는 Fe(iron) 매개의 지질과산화(lipid peroxidation)에 의해 유도되는(regulated) 세포사멸이다.
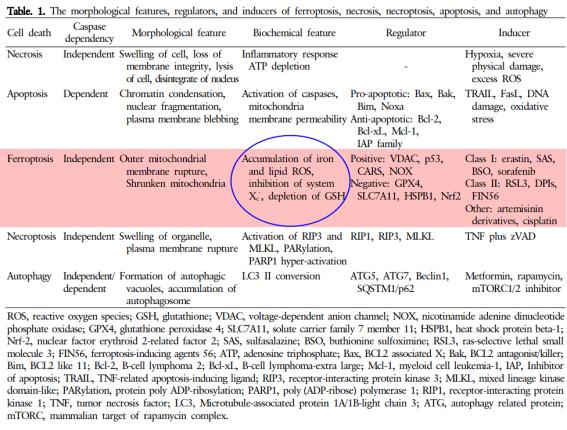
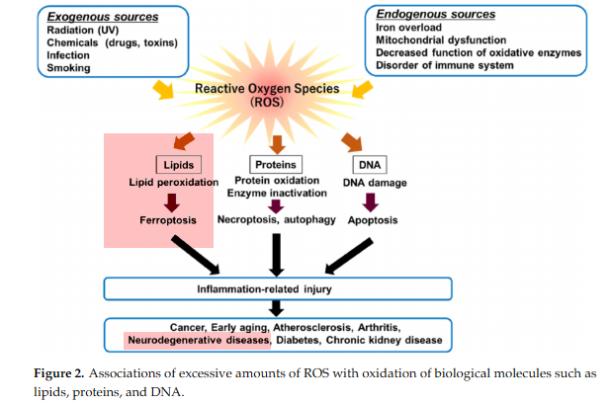
○ Hosohata 등(2022)에 따르면 Figure 2에서처럼 생성된 ROS는 지질(lipid)과 반응하여 연쇄반응을 통해 다량의 지질성 라디칼(lipid ROS) 생성하게 된다. 이는 결국 염증성 손상을 통해 퇴행성신경질환을 비롯하여 다양한 질환을 유도한다. 또한 ROS가 거대 분자 중 DNA와 결합하여 apoptosis, 그리고 단백질과 결합하여 단백질 산화 및 효소 불활성화를 통해 프로그램화된 세포괴사가 유도된다.

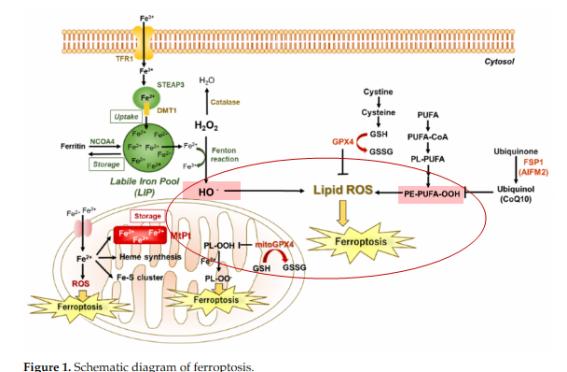
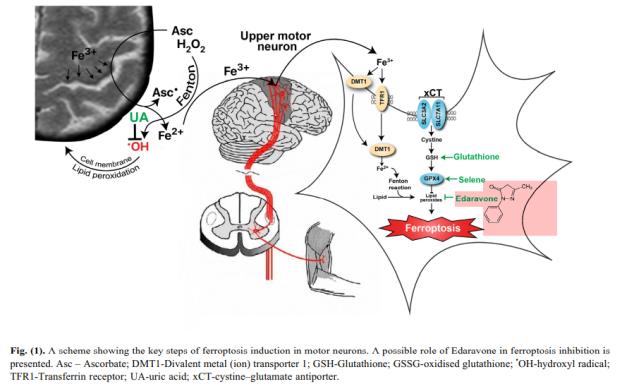
○ Edaravone May Prevent Ferroptosis in ALS: Fig. (1)은 Spasc 등(2022)은 Edaravone이 ALS 환자에서 세포의 ferroptosis를 저해하는 항산화물질로 확인하였다. Fenton pathway를 통해 생성된 hydroxyl radical은 지질과의 연쇄반응을 통해 산화적 스트레스를 유도한다. <그림>에서 붉은 부분에서 화학구조식의 Edaravone은 직접적으로 free radical인 lipid peroxide와 반응하여 제거하는 항산화성 기전을 나타낸 것이다. 따라서 Edaravone의 항산화성에 대한 MOA는 ROS를 비롯한 유기성 free radical과의 직접적인 반응성에 기인하는 것으로 추정되었다( Abe 등, 2004; Spasic 등, 2020). 그러나 Spasic 등(2020)의 논문에서는 이와 같은 운동신경세포의 ferroptosis에 의한 ALS 발생은 중추신경계에서 발생하여 상부운동신경(upper motor neuron)의 손상을 유도한다. 이는 필자가 접근하고자하는 가설인 근육에서 발생한 ROS 및 산화적 스트레스에 의한 하부운동신경세포(lower motor neuron) 손상과 ALS 진행과는 원천적인 측면에서 차이가 있다고 할 수 있다.
4. ALS 환자에서 Riluzole과 Edaravone의 항산화적 효과
○ 다음의 결과는 FDA에서 허가된 두 약물인 Riluzole과 Edaravone의 항산화성을 ALS 환자 혈액에서 확인한 것이다. 혈액에서의 측정이란 systemic oxidative stress에서 측면의 접근이다. 혈액에서의 산화성이 어디에서 연유하였는지는 확인이 불가능하지만, 혈액에서의 2 약물의 항산화적 능력은 혈관을 따라 전 조직으로 영향을 주기 때문에 ALS 환자의 기능약화 및 수명 단축을 지연시키는 역할은 하는 것으로 사료된다. 예를 들어 인체에서 대표적인 항산화 물질인 glutathione은 간에서만 합성되어 인체 전 조직에 분산되어 항산화 기능을 한다. 따라서 혈액에서의 산화적 지표에 두 약물의 영향을 통해 항산화성을 ALS 환자로부터 확인이 가능하다고 할 수 있다.
1) Riluzole의 systemic oxidative stress에 대한 항산화적 효과
○ Bonnefont-Rousselot 등(2000)은 미국 FDA으로부터 허가받은 질병-진행 조절제(disease-modifying drug, 일종의 Palliative)인 riluzole의 항산적 효과를 확인하기 위해 ALS 환자 167명의 혈액에서 산화적 스트레스 지표가 측정되었다. 환자들의 평균 나이는 59±13세로 연령-보정된 평균 60±11세 정상대조군의 혈액과 비교되었다. 결과는 2가지 측면인 산화적 스트레스의 지표 그리고 항산화적 지표 등을 통해 이해할 수 있다. 먼저 혈장의 산화적 스트레스이며 지표인 지질과산화(lipid peroxidation) 생성물인 TBARS(thiobarbituric acid-reactive substances)는 (ALS=1.34±0.28 micromol/l; controls=1.11±0.20 micromol/l)으로 유의하게 ALS 환자에서 높았다. 혈액의 항산화적 지표인 적혈구 SOD 활성은 대조군보다 환자에서 유의하게 높았다(erythrocyte SOD activity; ALS=71±114 U/g Hb vs controls=667± 93 U/g Hb). 그러나 또 다른 항산화 지표인 selenium level, GSH-Px activity, vitamin E, beta-carotene과 vitamin A 등의 혈액 농도에서는 대조군과 차이가 없었다. 혈액에 수많은 종류의 효소적 및 비효소적 항산화 시스템이 존재하는데 ALS 환자에서 단지 SOD의 증가는 항산화적 방어의 일환으로 볼 수 있다. 이와 같은 연구 결과를 통해 ALS 환자에서 systemic oxidative stress가 증가되는 것이 확인되었다. 특히 장기간의 관찰에서도 ALS 환자에서 혈액의 산화적 지표가 확인되어 ALS 환자의 증가된 systemic oxidative stress가 일시적이 아닌 chronic oxidative stress로 BBB를 통해 뇌 등의 신경계에 영향을 줄 수 있는 요소로 해석할 수 있다. ALS 진행 조절약물인 Riluzole를 처리한 후 ALS 환자군의 산화적 지표에서 변화가 없었고 SOD 활성이 감소되는 현상 (treated=705±113 U/g Hb; not treated=725±118 U/g Hb) 외에 그 어떠한 항산화적 지표에서 변화가 없었다. 이는 Riluzole이 ALS 환자의 systemic oxidative stress에 대한 항산화 효과가 없는 것으로 추정된다.
2) Edaravone의 oxidative stress에 대한 항산화적 효과
○ Edaravone의 항산화성을 확인하기 위해 다 양한 방법으로 확인되었지만 in vitro 또는 동물 모델로 대부분이었다. 원본 자료의 부족으로 Bhandari 등(2018)의 초록을 인용하여 ALS 환자에서 항산적 효능 을 확인할 수 있었다. ALS 환자 368명을 대상으로 4주 간격으로 60분에 걸쳐 매우 천천히 Edaravone 60 mg를 투여한 결과, Edaravone이 신체 물리적 기능의 상실 및 악화를 플라시보군보다 약 33% 정도의 지연을 유도하였다. 이는 ALS 환자에서 운동신경의 상실을 유도하는 산화적 스트레스를 예방하는 강력한 항산화성으로 추정되었다(Edaravone is a strong antioxidant that prevents oxidative stress from inducing motor neuron death in ALS patients. Bhandari 등, 2018).
5. 요약 및 결론
○ FDA 및 EMA에서 허가받은 ALS의 disease-modifying drug인 Riluzole과 Edaravone 등의 2개 중 하나인 Edaravone에 의해 ALS 환자에서 항산화성이 다소 확인되었다. 그러나 이러한 항산화성이 Edaravone의 MOA으로 파악되고 있는 ROS 등을 비롯하여 free radical과 직접적인 결합에 의한 것인지는 확인되지 않았다. 중요한 점은 허가받은 ALS 약물의 2개 중 하나는 산화적 스트레스에 의한 항산화성 MOA에 기반한다는 것이며 이를 바탕으로 여기서 추구하고자 하는 것을 위해서는 어떤 방향이 필요한지 고찰이 필요하다고 할 수 있다. 여기서 ALS 환자를 위한 disease-modifying drug를 개발하기 위한 가설은 근육세포의 미토콘드리아에서 uncoupling reaction 등에 의한 ROS(reactive oxygen species)에 기인하며 이에 의한 영향으로 운동신경의 퇴화 및 ALS가 유도된다는 것이다. 따라서 근육세포에서 ROS 생성과 미토콘드리아의 기능저하 등에 대한 비침습적 바이오마커(biomarker)를 확인할 필요성이 있으며 특히 혈액에서 이러한 현상을 반영할 수 있는 바이오마커가 무엇보다도 중요하다고 할 수 있다. 항상 그러하지만 어떠한 질병의 약물 개발을 위해서는 가설 설정에 적절하고 sensitivity와 specificity가 높은 인체 바이오마커 를 설정하는 것이 무엇보다도 중요하다.
