○ Systemic source of oxidative stress and extra-CNS involvement for ALS: D’Amico 등(2013)은 다음과 같은 문장으로 systemic oxidative stress에 대한 중요성을 확인하였다: Whereas oxidative stress appears to be closely associated with motor neuron degeneration in ALS, it still remains unsettled whether oxidative stress is involved outside of the CNS such as in skeletal muscles and in gut(Dupuis 등, 2009; Bogdanov 등, 2000; Mitsumoto 등, 2008). Reliable oxidative stress biomarkers are the first essential step to ascertaining such extra-CNS involvement (Oxidative stress가 ALS 환자에서 운동신경세포의 퇴행을 유도한다는 것은 확실하지만 oxidative stress가 근육 등과 같이 CNS 외 지역에서 어떻게 연관성이 있는지에 대해 우리는 여전히 알 수 없다. 이에 ALS 환자를 위한 disease-modifying drug를 개발하기 위해서는 중추신경계 외에서 발생하는 oxidative stress의 원천 즉, extra-CNS involvement에 대한 확인이 무엇보다도 중요하다고 할 수 있다). 이는 필자의 systemic oxidative stress vs local oxidative stress vs in situ oxidative stress 등과 ALS와의 관계에 대한 이해가 disease-modifying drug을 개발하는데 있어서 중요하다는 것을 대변하는 문장이라고 할 수 있다. 여기서 systemic oxidative stress는 곧 systemic source of oxidative stress와 its extra-CNS involvement for ALS의 개념이다.
1. Systemic oxidative stress의 대표적인 source 추정
1) Gut-Brain Axis (장-뇌 연결축)의 개념과 oxidative stress
① 장-뇌 연결축의 2가지 경로: 장-뇌 연결축이란 장에서 생성된 물질들이 뇌신경계로 연결되는 것을 의미하며 2가지 경로가 있다. 첫 번째는 아래 <그림> 내 (1) 경로로 장내분비세포(enteroendocrine cells) - 미주신경(vegus nerve) - 결절성 신경절(nodose ganglia) - 뇌로 연결되는 경로이다. 또 다른 한 경로는 장내세균에 의한 자극에 의한 장내 상피세포에서 면역반응의 유도를 통해 cytokine를 비롯하여 장내세균에 의해 발생한 및 대사체 등이 전신혈관계를 통해 뇌-혈관 장벽(blood brain barrier)을 통해 뇌로 이동하는 경로이다. 특히, 뇌의 최종 관문인 BBB의 통과 없이 장내에서 생긴 독성물질 및 산화적 스트레스의 결과몰이 큰 방해 없이 바로 직접 뇌로 전달할 수 있다는 사실은 대장 내 좋은 microbiome 유지가 ALS를 비롯한 신경퇴행성질환에 대단히 중요한 요인으로 이라는 것을 알 수 있다. Figure 1은 장내 미생물에 의해 발생한 전-염증성(pro-inflammatory) 반응으로 장내세균의 증식은 ROS 생성을 유도한다(Obrenovich 등, 2020; Boddy 등, 2021). 특히 이들 전-염증성 반응은 gut-brain axis를 통해 신경계 그리고 최종적으로 운동신경계에서 산화적 스트레스의 증가로 ALS가 유도되는 것을 도식화한 것이다(Toledo, 등 2022). 전-염증성 반응으로 분비된 cytokine은 신경계의 점차적으로 상해를 유도하며 자가회복(self-repairing) 과정을 저해한다(Guerreiro 등, 2020; Chen 등, 2016). 장내(Gut)에서 나쁜 microbiome으로 바뀌면 알데하이드 등과 같은 독성물질이 생성되어 장벽(Intestinal wall)에 장상피세포(Intestinal epithelium)에 생긴 틈(Clearence)으로 내장 내에서 산화적 스트레스의 유독성 부산물이 인체 내로 침범하여 장내 면역체계에서 전-염증성(pro-inflammatory) 반응 상태에서 염증(Inflammation)이 일어난다. 장 상피세포를 투과한 물질은 혈액을 통해서 곧바로 뇌로 이동하여 BBB를 통과하면 뇌 염증과 관련 각종 뇌 질병이 발생할 수 있다. 하지만, BBB가 작동하여 독성물질을 통과를 거부할 수도 있지만, 장에서 올라온 독성물질은 BBB의 기능을 파괴할 수도 있다. 단지 혈액을 통한 뇌로 이동뿐만 아니라 또 다른 대장과 뇌를 통하는 gut-brain axis는 뇌 방어 최후 보루인 BBB의 통과 없이 직접 뇌에 작용한다.
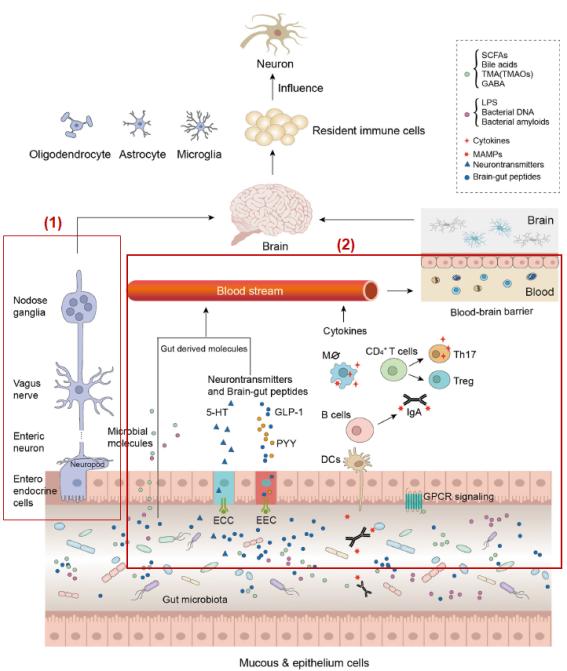
<그림> Gut-Brain Axis (장-뇌 연결축)의 2가지 경로
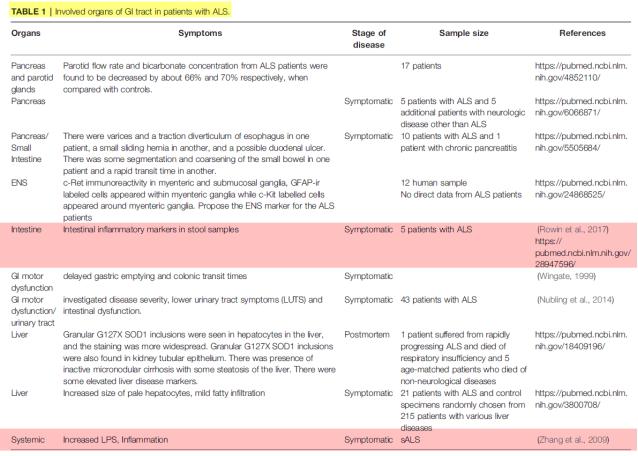
② 루게릭병 환자의 위장계 질병(Gastrointestinal disorders in human ALS): 아래의 Table 1은 ALS 환자들을 대상으로 소화기계 증상에 대한 여러 연구자료를 검토한 것을 최근에 요약하여 발표한 것이다(Martin 등, 2022). 조사의 결론은 ALS 환자에게서 위장계 증상이 ALS 초기 단계이거나 ALS 진단 이전에 나타나는 것으로 확인되었다. 그러나 대부분의 ALS 환자들에게서 위장계 증상이 ALS 진단 이전에 무시되었다는 것을 알 수 있다. ALS 환자에서 위장계 증상과 관련하여 가장 최근 Rowin 등(2017)에 의해 수행된 연구는 ALS 환자로부터 대변 샘플을 채취하여 장의 염증과 인체 장내세균군(microbiome)에 대한 지표를 이용하여 감염 여부를 평가한 최초 연구이다. 분석에 따르면 모든 환자들에서 장 염증(intestinal inflammation)의 증상이 확인되었다. 이보다 앞서 수행된 Zhang 등(2009)의 연구에 따르면 산발형 ALS(sALS)의 환자군에서 혈장 lipopolysaccharides (LPS), 세균성 내독소(endotoxin) 등이 농도가 혈액 단핵구와 대식세포 활성이 비례적으로 증가하는 것이 확인되었다. 특히 혈장 LPS는 sALS 환자에서 가장 많이 증가되는 지표이다. 이와 같이 sALS 환자군에서 혈액에서의 세균성 내독소와 혈액에서 면역 활성화는 장에서의 누수현상과 국소 염증의 발생을 의미한다.
2) ALS 환자에서의 Hypermetabolism
① 대사과다증과 ALS: 필자가 검색을 통해 Desport 등(2001)의 논문에서 다음과 같은 문장을 확인하였다; A higher than expected proportion of ALS patients is hypermetabolic, with low body mass index (BMI) . 기본적으로 이해가 필요한 용어는 Hypermetabolism과 BMI이다. 대사과다증(Hypermetabolism)은 체내 기초대사율(body's basal metabolic rate)이 비정상적으로 증가하는 상태를 의미한다. 생명과정에 필요한 최소한의 에너지량을 의미하는 기초대사량은 인간과 동물이 활동을 하지 않는 휴식상태에서도 뇌의 활동, 심장 박동, 간의 생화학 반응 신체의 생명활동 기능을 유지하기 위해서 필요한 에너지의 양을 말한다. 일반적으로 남성은 체중 1kg당 1시간에 1kcal를 소모하고, 여성은 0.9kcal를 소모하는 것으로 알려져 있다. 따라서 대사과다증은 체중 1kg당 1시간에 1kcal보다 훨씬 높은 열량이 요구된다는 증상이다. BMI(body mass index)는 체지방량의 유용한 지표로 키와 몸무게를 이용하여 지방의 양을 추정하는 비만 측정법이다. BMI는 몸무게를 키의 제곱으로 나눈 값이다. 예컨대 키가 160㎝이고, 몸무게 60㎏인 사람의 체질량지수는 60÷(1.6*1.6)=23.4가 된다. 그 수치가 20 미만일 때를 저체중, 20~24일 때를 정상체중, 25~30일 때를 경도비만, 30 이상인 경우에는 비만으로 본다. Desport 등(2001)의 연구 결과는 ALS와 대사과다증과 밀접한 관계가 있다는 것을 의미한다. 즉, 낮은 BMI와 높은 대사율을 가진 사람은 ALS에 걸릴 확률이 높다는 것이다. 또한 임상시험에서 낮은 BMI와 높은 대사율을 가진 사람이 대조군에 많이 구성되어 있다면 특정 요인과 ALS 발현과의 인과관례를 규명하는데 있어서 장애 요인으로 작용할 가능성도 있다는 것을 의미한다.
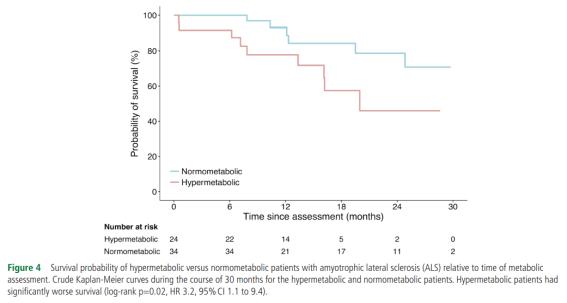
② ALS 환자에서 대사과다증 비율과 수명차이: 대사과다증은 산발혈 ALS 환자 중 25%에서 68%의 환자에서 확인되었다(Bouteloup 등, 2009; Desport 등, 2001; Desport 등, 2005; Funalot 등, 2009). 최근 2018년 수행된 Steyn 등(2018)의 연구에 따르면 ALS 환자 중 대사과다증을 가진 환자는 41% 그리고 일반인 대조군의 대사과다증을 사람은 12%로 대사과다증을 가진 사람이 ALS의 교차비(odds ratio)은 5.4이다. 즉, 대사과다증을 가지면 ALS에 걸릴 수 있는 위험이 없는 사람보다 5.4배 높다는 뜻이다. 특히 아래의 figure 4는 ALS의 환자 중 대사과다증(hypermetabolic)을 가진 환자와 정상대사성(normometabolic) 환자와의 남은 수명에 대해 12개월 동안 분석한 결과, 대사과다증 ALS 환자군에서는 60%, 반면에 대사과다증 ALS 환자군에서는 40%로 평균수명의 기간에서 유의한 차이가 확인되었으며 ALS 환자에서 대사과다증이 사망위험을 약 220% 증가시킨다. 이에 대사과다증은 ALS의 위험인자일 뿐만 아니라 ALS 환자의 평균수명에도 큰 영향을 주는 요인으로 추정된다.
③ ALS 환자에서 glycolitic pathway vs oxidative pathway: Quessada 등(2021)은 ALS 환자에서 에너지대사의 변형 즉, glycolitic pathway가 감소되고 oxidative pathway가 증가되는 이유를 Figure 2를 통해 요약하였다. 세포질에서 발생하는 glycolitic pathway과 fatty acid의 β-oxidation 결과로 생성된 acetyl-coA는 Krebs cycle를 통해 ATP와 전자전달계에 전달할 환원력 NADH가 생성된다. 세포질에서 진행되는 glycolytic pathway와 미토콘드리아에서 이루어지는 oxidative pathway는 상호협력적 관계이지만 또한 경쟁적인 관계이다. 그러나 glycolytic pathway를 통해 생성된 pyruvate가 acetyl-coA와 Co 2 로 생성되는 과정에 작용하는 효소인 PDH(Pyruvate dehydrogenase, 피루브산 탈수소 효소)가 PDK4(Pyruvate dehydrogenase kinase 4, 피루브산 탈수소효소 키나아제4)에 저해된다.
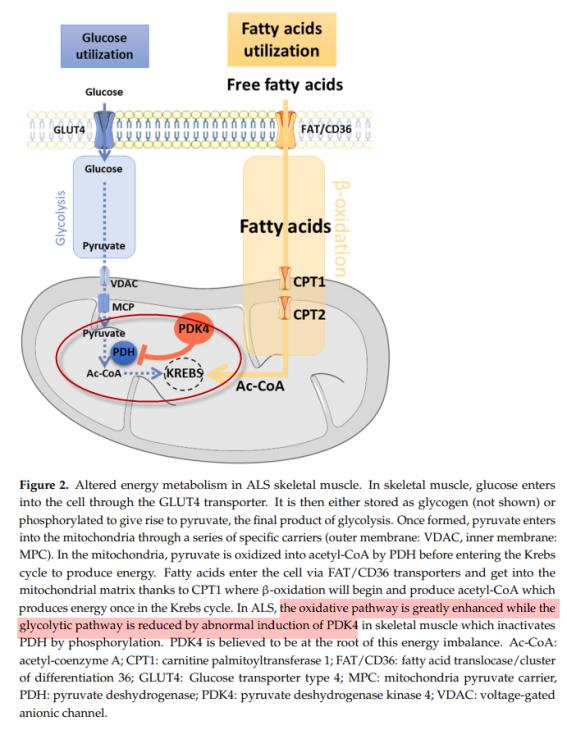
④ ALS 환자에서 glycolitic pathway 원인과 PDK4 발현 증가: Table 3에서처럼 ALS 환자에서 PDK4 mRNA 발현이 3-4배 증가하고(Palamiuc 등, 2015; Desseille 등, 2017), 특히 근육에서 glycolytic pathway가 oxidative pathway로 전환된 근육섬유가 확인되었다(Telerman-Toppet 등, 1978). PDK4의 과발현은 glucose_ fatty acid flux의 균형을 무너뜨리고 mitochondria의 기능장애(dysfucntionality)를 유도하게 된다.

2. Hypermetabolism에 의한 Systemic vs Local oxidative stress
○ 필자가 지금 논하고 있는 systemic oxidative stress의 source에 대한 논의에서 Hypermetabolism을 포함하는 것은 다음과 같은 내용을 통해 타당하다고 할 수 있다. Although of unknown origin, excessive energy expenditure has been hypothesized to be dependent on defective mitochondrial function in liver, muscle, and spinal motoneurons(과도한 에너지 소비인 excessive energy expenditure는 ALA 환자의 간, 근육 그리고 척수운동신경 등의 다양한 기관에서 발생하고 주로 미토콘드리아 결함 및 장애에 기인하는 것으로 이해된다; Quessada 등, 2021; Ferri 등, 2017; Menzies 등, 2002; Bacman 등, 2006). 즉, 대사과다증이 신체 전체에서 발생하며 이는 미토콘드리아의 기능장애를 통한 ROS 생성과 oxidative stress가 증가되는 것으로 추정된다. 그러나 Hypermetabolism의 가장 밀접한 관계는 근육이며 이는 ALS와 가장 연관성이 있으며 이에 근육과 hypermetabolism 그리고 oxidative stress는 ALS 병리 기전에서 중요한 축으로 사료된다. 물론 아래의 <그림> 전신혈관계가 근육과 연결되어 당연히 systemic oxidative stress가 근육에 영향을 주면 ALS에서도 원인이 될 수 있다.
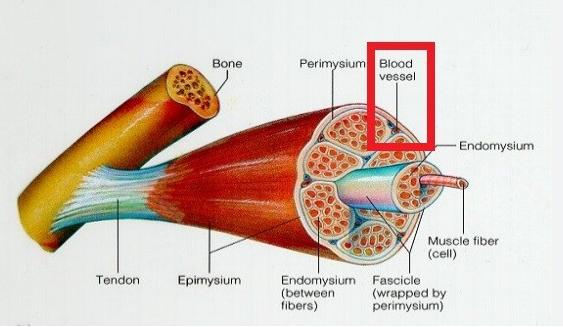
<그림> 골력근을 감싸고 있는 연결조직
그러나 systemic oxidative stress는 신경계 측면에서 본다면 중축신경계에 먼저 영향을 주고 이후 운동신경계에 영향을 주는 가능성이 높다. 이는 루게릭병을 가진 환자에서 인지장애(cognitive impairment)가 선행하여 나타나지 않는다는 것과 일치한다. 특히 중추신경계의 염증을 유발하는 중요한 원인이 뇌조직에서 신경줄기세포에서 유래하지 않는 유일한 세포인 미세아교세포(microglia)는 염증반응을 통해 산화적 스트레스를 CNS에서 유발한다. 이와 같은 산화적 스트레스는 ALS보다 알츠하이머 및 파킨슨 질환 등의 영향을 통해 인지장애에 영향을 유도한다. 따라서 CNS에서의 염증 및 산화적 스트레스는 인지장애에 우선하기 때문에 치매 및 파킨슨 환자에서 ALS 발생은 당연히 후행적이라고 사료된다. 따라서 ALS와 systemic oxidative stress에는 운동신경과 근육에서 발생하는 local oxidative stress를 우선하여 이해할 필요성이 있다. 이 중심에 hypermetabolism이 존재하기 때문에 근육에서 hypermetabolism에 의한 산화적 스트레스가 직접적으로 운동신경세포 영향을 주는 것으로 local oxidative stress로 분류할 수 있으며 이에 대한 이해는 disease-modifying drug를 개발하는데 중요한 실마리가 될 것으로 사료된다. 예를 들어 ALS 환자의 근육세포 미토콘드리아에 존재하는 PDK4 항체 개발은 ALS 환자의 근육 기능 향상과 수명 연장에 중요한 항체조절체가 될 수 있기 때문이다.

