○ 미국 FDA에서 ALS disease-modifying drug으로 허가된 riluzole과 edaravone에 대한 약리기전과 그 외 특성을 나타낸 것이다. ALS disease-modifying drug이란 ALS를 완전히 치료하는 것이 아니라 증상의 진행을 늦추는 질병 조절제(disease-modifying drug)를 의미한다. ALS가 운동신경세포의 손상과 죽음에 기인하는 질환이기 때문에 약물로는 이들 세포를 다시 건강한 상태로 되돌리는 것이 불가능하다. 이에 ALS 진행을 지연시키거나 증상을 완화하는데 중점을 두어 개발하는데 의미가 있으며 병용투여는 또 다른 수명 연장의 기회를 제공할 수 있다는 점에서 의미가 또한 있다.
1. 루게릭병과 oxidative stress-기반 Disease-Modifying Drug 개발을 위한 새로운 접근의 필요성
1) 불명확한 원인
○ 가족형 ALS(familar ALS)와 산발형 ALS(sporadic ALS)의 발생 비(ratio)는 1:9로 환경적인 요인을 가장 높은 원인으로 ALS 병인론으로 추정되고 있다. 환경적 요인이란 그 원인 불명확하다고 개념는 동일하고 이 환경적 요인이 아래의 8가지에 어떻게 영향을 주는가에 따라 ALS가 발생할 수 있다. 물론 유전적인 결함에 의한 영향도 혼합적으로 발생할 수 있다(Editorial. 2021).
① Glutamate excitotoxicity와 같은 흥분세포독성(excitotoxicity)
② 신경아세포 활성화(glial activation) 및 자가면역성기전에 의한 만성 염증
③ 유해활성산소종 또는 산화적 스트레스(oxidative stress)
④ 신경세포간 물질이동의 이상에 의한 신경영양물질 등의 결핍
⑤ 운동신경세포의 골격(cytoskeleton) 및 축삭(axon)의 운반에서 이상
⑥ RNA metabolism의 결함
⑦ 단백질 항산성의 변화
⑧ 미토콘드리아의 기능저하
2) 다양한 병인론에 기인한 ALS 환자에 대한 기전적 표적의 실패
○ ALS 환자의 질환사는 ALS 발현이 fALS 또는 sALS의 어느 기전에 의존하여 발생하든지와는 상관이 없이 종국에는 운동신경세포의 apoptosis 및 necrosis에 의한 운동신경의 손상과 이에 의한 환자의 사망 과정이다(Schimke et al., 2022; ALS 정의: This neurodegenerative disease is characterized by the progressive loss of upper motor neurons in the cerebral cortex and lower motor neurons in the brain stem and spinal cord , leading to muscle weakness, and progressing into muscle atrophy and paralysis, which culminates in respiratory failure and death) . 이에 의해 ALS 진단 후 평균 약 4년 그리고 근마비 후 호흡곤란으로 1-2년 내에 환자는 사망에 이른다(Wijesekera et a., 2009; Forsgren et al., 1983). 이는 다른 어떤 질환보다 짧은 ALS 환자의 진단 후 빠른 사망은 결국 운동신경세포의 죽음에 의한 근마비 그리고 호흡계 작동중지에 기인한다. 따라서 운동신경세포의 사멸이 얼마나 빠르게 발생하느냐에 따라 진단 후 환자 사망이 결정되지만 일반적으로 발생부터 사망까지 상당히 빠른 질환으로 분류되고 있다(Westeneng et al., 2018). 따라서 다양한 병인론과 질환의 빠른 진행은 ALS 병인론적 network과 오늘날 약물 개발의 기전적 표적에 있어서 심각한 Gap이 존재하게 만드는 원인이 다. 실제로 지금까지 미국 FDA에 의해 승인된 약물은 평균적으로 3-5개월 정도 생존기간을 연장하는 Riluzole과 ALS 환자의 기능 저하 속도를 늦추는 Edaravone 뿐일 정도로 ALS 환자의 수명을 단지 몇 년을 연장을 할 수 있는 약물은 없는 상태이다.
2. 루게릭병에 대한 oxidative stress-기반 Disease-Modifying Drug 개발의 이론적 접근
1) 8가지 병인론 중 약물 개발의 기전적 표적에 대한 단일화의 필요성
○ 앞서 언급한 8가지 ALS 병인론을 제시하였다(Editorial. 2021). 독성학-기반 병인론적으로 고려했을 때 이들 ALS의 8가지 병인론 중 산화적 스트레스는 7가지 병인론의 선행적 요인이며 연쇄적 및 순환적 반응을 유도한다. 비록 적은 수의 논문과 단기간의 리뷰이지만 이와 같은 추정은 지금까지 ALS 연구의 논문을 통해 언제든지 증명이 가능하다는 것이 필자의 독성학적 이해이다. 따라서 루게릭병과 oxidative stress-기반 Disease-Modifying Drug 개발을 위한 새로운 접근 방법을 위해서는 아래의 <그림-A>를 <그림-B>와 같은 모형으로 변형하여 단순한 기전적 이론의 접근 필요성이 있다고 할 수 있다.
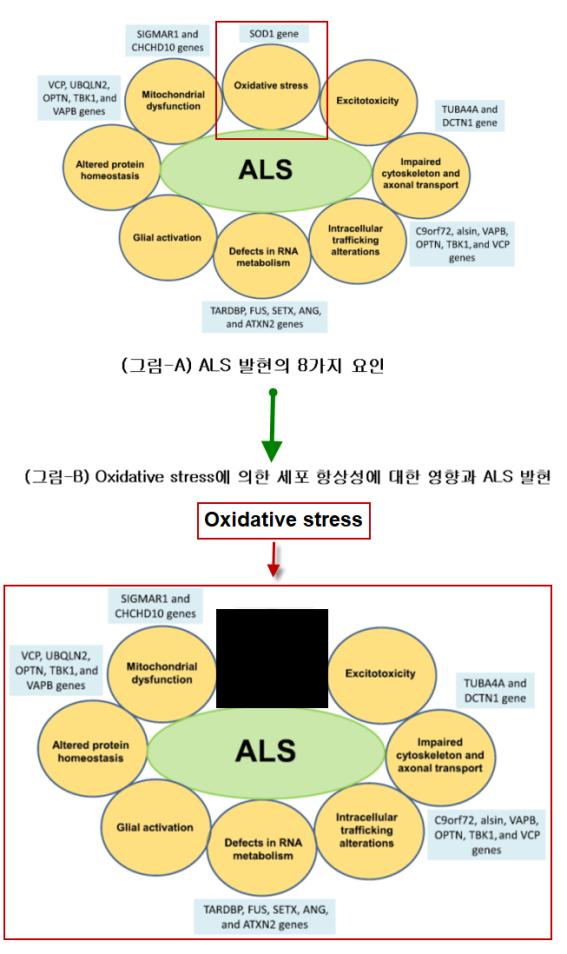
2) ALS 환자의 항산화적 결함의 요인에 대한 이해
○ 아래의 <그림>에서처럼 oxidative stress는 체내 또는 세포내에서 항산화물질과 산화물질의 불균형(imbalnce)에 의해 발생한다.
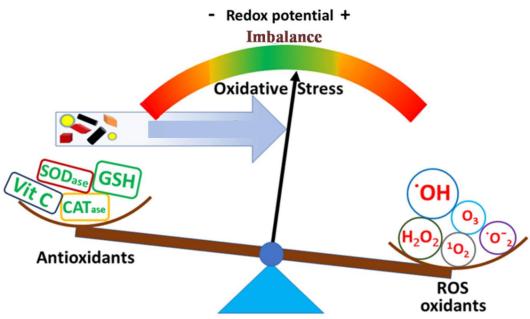
<그림> 항산화성과 산화성의 불균형에 의한 Oxidative stress
○ 물론 역학조사를 통해 ALS 환자에서 oxidative stress와 관련된 유전자인 SOD1의 돌연변이가 전체 ALS 환자군에서 2.0%가 확인되었다(Grassano et al., 2022). SOD(superoxide dismutase)는 superoxide radical을 과산화수소로 바꾸는 효소이며 과산화수소는 다시 catalase 또는 glutathione에 의해 산소와 물로 전환된다. 그러나 비록 정상이라고 하더라도 catalase나 glutathione(GSH)이 없다면 항산화효과를 얻을 수 없다. 특히 glutathione은 간에서만 생성되어 혈관계를 통해 전신으로 이동하여 산화적 방어를 하는 생체 내 최고로 많이 존재하는 항산화물질이다. 따라서 간에서 GSH 생성에 대한 강도 등을 비롯하여 ALS 환자에서 다양한 산화적 스트레tm의 프로파일에 대한 확인은 중요하다고 할 수 있다.
3) ALS 발현과 산화적 스트레스의 원천에 대한 이해
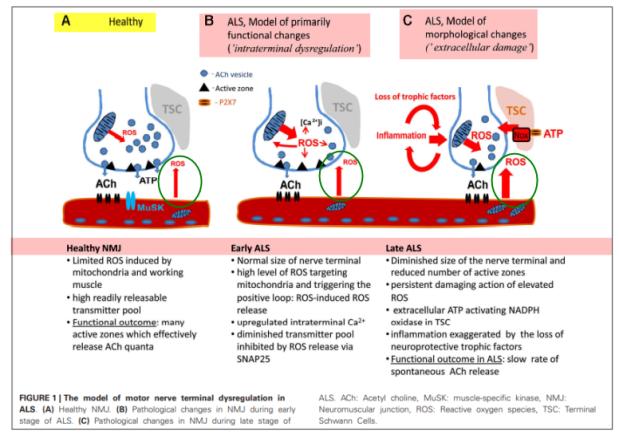
○ FIGURE 1은 ALS 발현에 있어서 운동신경세포의 말단 조절장애에 대한 모델을 나타낸 것이며 이러한 조절 장애가 산화적 스트레스에 기인한다는 것을 도식화한 것이다(Pollari et al., 2014). 정상적인 건강인의 운동신경에서는 미토콘드리아에서의 제한된 ROS 생성으로 근초(근육세포 세포막)의 신경근육이음부(neuromuscular junctionm NMJ)에서 ACh(Acetylcholine, 아세틸콜린) 수용체에 결합한다. 신경근육이음부는 muscle-specific kinase(MuSK), agrin 등 여러 분자들로 구성되어 성숙 및 유지된다. TSC(Terminal Schwann Cell, 종말 수초)에 의해 싸여있는 시냅스전 종말의 미토콘드리아에서 ROS가 많이 분비되면 칼슘이온 유입이 증가되고 또한 세포막과 AcH 신경전달물질을 가지고 있는 소낭과의 융합을 매개하는 단백질인 SNAP-25(synaptosomal-associated protein of 25 kDa)를 통한 ROS 방출은 신경전달물질 AcH 총량의 감소를 유도한다. 일부에서는 근육섬유가 ALS 발현을 유도하는 초기 변화의 장소로 제시되기도 하였다(Wong et al., 2010). 그러나 대체적으로 ALS의 시작은 마우스 모델을 통해 NMJ의 전시냅스 작동(presynaptic machinery)의 문제로 발생하는 것으로 이해되고 있다(Pollari et al., 2014). 특히 후반 ALS(late ALS)에서는 신경영양인자(neurotrophic factor) 부족과 염증(inflammation) 발생 등에 기인하여 신경근육이음부에 위치한 신경 종말(neuron terminal)의 크기 감소로 신호전달의 전반적인 기능이 감소된다. 이러한 감소는 ROS 생성에 의한 조절장애와 손상에 기인하는데 ROS 생성의 중요한 특성은 지속적인 연쇄반응을 통해 다른 원천과 영향을 통해 산화적 스트레스의 심화를 유도하는 것이다. 결과적으로 신경의 축삭돌기를 감싸고 있는 슈반세포 (Schwann cells) 손상도 동반되어 FIGURE 1의 C에서처럼 AcH 방출이 극단적으로 저하되어 운동시경의 기능이 상실된다. 따라서 마우스 모델을 통해 신경근육이음부의 ROS-유도 취약성(vulnerability)이 ALS 발현의 시작 및 진행에 중요한 기전으로 이해되고 있다. 그러나 본 연구에서 우리가 중요하게 생각하는 것은 아래 <그림>에서 녹색원 부분인데 산화적 스트레스가 근육에서도 발생하여 운동신경세포에 주는 영향이다. 즉, 반드시 운동신경세포에서만 발생한 산화적 스트레스에 의해 ALS가 발생하지 않고 주변조직에서 발생한 산화적 스트레스에 의해 영향을 받는 다는 것이다.
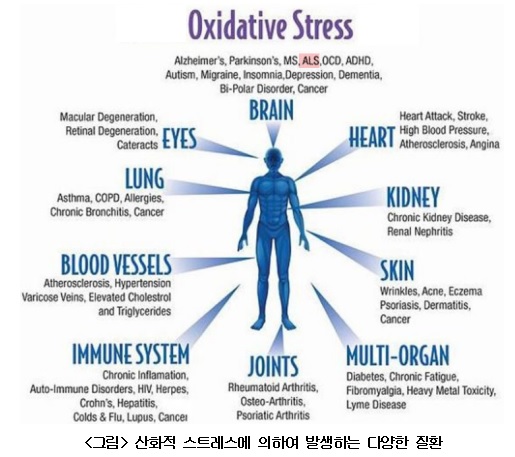
4) Systemic vs Local vs In situ oxidative stress에 대한 이해 필요성
○ 아래의 <그림>과 같이 산화적 스트레스 ALS를 포함하여 다양한 조직에서 다양한 질환의 병인론으로 대두된다. 만약에 특정 염증 및 다른 요인에 발생한 산화적 스트레스가 전신혈관계를 통해 운동신경세포에 영향을 주는 systemic oxidative stress, 신경아교세포(neuroglial cell) 등 신경계 세포 등에 의해 발생한 산화적 스트레스가 주변 운동신경세포에 영향을 주는 local oxidative stress 그리고 운동신경 자체에서 발생하는 산화적 스트레스 in situ oxidative stress 등의 3가지 측면에서 ALS 발현에 대한 이해가 필수적이다. 그러나 무엇보다도 중요한 것은 systemic oxidative stress에도 불구하고 왜 하필이면 운동신경세포의 손상과 연결되어 ALS 발현인가의 질문에서처럼 산화적 스트레스에 대한 운동신경세포의 특정 vulnerability(취약성)이 있는 가에 대한 이해가 우선되어야 한다. 즉, 유전자 결함과 환경요인이 원인일 경우에 산화적 스트레스와 관련된 모든 질환이 전부 유도되어야 하는데 왜 ALS만 유도되는가와 같은 의문이 있다. 이러한 의문을 이해하기 위해서는 운동신경세포 만이 특이적으로 oxidative stress에 대한 vulnerability에 대한 이해가 필요하다.
5) 신경세포 및 운동신경세포의 산화적 스트레스에 대한 vulnerability(취약성)
○ 생체는 수정을 통해 모든 세포가 동일한 유전자를 가지고 있지만 분화 과정에서 주어진 환경에 따라 유전자의 발현 유무에 의해 특정 세포 및 조직으로 분화된다. 따라서 산화적 스트레스와 관련된 유전자에 돌연변이 등과 같은 문제가 있다면 생체 세포 및 조직 등에서 동일하게 발생할 수 밖에 없다. 이러한 측면을 고려할 때 동일한 유전자적 문제에서 신경세포 및 운동신경세포가 왜 생체 전체에서 발생하는 systemic oxidative stress에 대해 더 민감한 것인가에 대한 요인 을 확인할 필요성 있다. 신경세포 및 운동신경세포가 산화적 스트레스에 더 민감한 이유는 다음과 같은 요인으로 정리된다.
1. 신경세포는 다른 종류의 세포막과 비교하여 arachidonic acid 및 docosahexaenoic acids 등과 같은 고도의 불포화지방산( polyunsaturated fatty acids)을 포함하고 있다. 이는 높은 비율의 산소 소 그리고 산화-환원 활성 전이 금속(redox-active transition metals)을 다량으로 함유하고 있어 ROS 생성에 더 민감한 직접적인 원인이 된다(Cosgrove et al., 1987)
2. 신경세포는 산화적 스트레스 발생과 비교하여 낮은 농도의 항산화물질을 가지고 있다(Contestabile et al., 2001; D’Amico et al., 2013).
3. 운동신경세포의 큰 크기에 따른 높은 산소 요구량으로 미토콘드리아에서 uncoupling reaction 가능성 높다( Bartolome et al., 2013) . 보통 세포의 평균 크기는 지름이 약 10 μm 정도인데 신경세포는 세포체(cell body)는 직경이 60 μm와 축삭 길이는 1 m 정도까지 된다. 이와 같은 크기 차이에 의해 다른 세포와 비교하여 산화적 스트레스 손상에 더 취약하다고 할 수 있다.
4. 운동신경세포에서 미토콘드리아는 고에너지 상태가 요구되고 동시에 칼슘 완충작용(calcium buffering)이 필요하다. 정상적인 운동신경세포에서의 미토콘드리아는 칼슘완충작용에 대한 충분한 능력을 가지고 있어 칼슘이온이 효율적으로 농도 조절이 가능하도록 고농도 지역에서 저농도 지역으로 이동되어 재배치된다(Wang et al., 2009). 그러나 과도한 칼슘이온의 미토콘드리아로 유입되어 ROS가 증가되면 미토콘드리아 손상으로 이를 제거하는 마이토파지(mitophagy)가 유도된다(Edens et al., 2016).
5. ALS의 중요한 요인으로 운동신경세포에서 유전자 결함, 흥분독성(excitotoxicity), 세포사멸(apoptosis), 미토콘드리아 조절장애(mitochondrial dysfunction), 염증(inflammation), 단백질 응집체(protein aggregate) 그리고 산화적 스트레스(oxidative stress) 등의 주요 요인으로 알려졌다( Grossman 등, 2019; Kiernan 등, 2011; Shi 등, 2010; Editorial, 2021 ). 그러나 무엇보다도 중요한 것은 ALS의 주요 요인들이 산화적 스트레스에 의해 일련의 발생하는 가능성이다(Shaw et al., 2005; Carri etal., 2003; Dupuis et al., 2009; Barber et al., 2006; Robberecht et al., 2000; Emanuele etal., 2013; Cunha-Oliveira et al., 2020) .
3. 루게릭병의 허가된 Disease-Modifying Drug 종류와 특성에 대한 이해
○ Riluzole과 Edaravone: 아래의 TABLE 1은 미국 FDA에서 ALS disease-modifying drug으로 허가된 riluzole과 edaravone에 대한 약리기전과 그 외 특성을 나타낸 것이다. ALS disease-modifying drug이란 ALS를 완전히 치료하는 것이 아니라 증상의 진행을 늦추는 질병 조절제(disease-modifying drug)를 의미한다. ALS가 운동신경세포의 손상과 죽음에 기인하는 질환하기 때문에 약물로는 이들 세포를 건강한 상태로 재생하는 것이기 완치가 약물로는 불가능하다. 이에 ALS 진행을 지연시키거나 증상을 완화하는데 중점을 두어 개발된다.
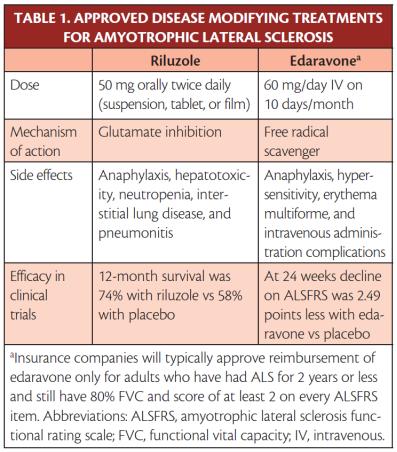
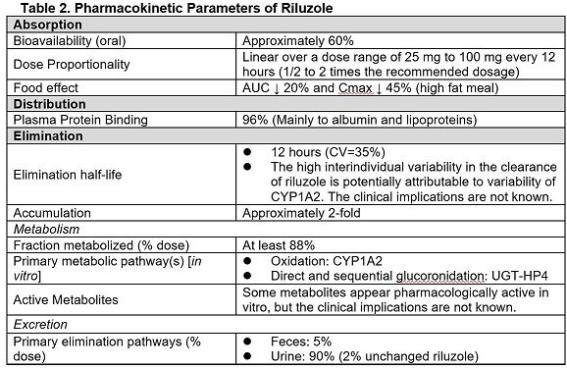
① Riluzole: Riluzole은 glutamate excitoxicity를 감소시키는 항흥분성약물(anti-excitotoxic agent)이다. 임상시험에서 Riluzole의 투약을 통해 ALS 환자의 12개월 생존은 74%, 위약대조군의 생존율은 58%로 약 2-3개월 생명을 연장하는 젓으로 추정되고 있다( Bensimon 등, 1994) . 그외 간독성을 비롯한 다양한 부작용이 확인되었다( Zachary et al., 2020). Table 2는 Riluzole의 PK parameter를 나타낸 것이지만 MOA 약리적 MOA는 명확하지 않다(Drug.com, 2022). 부작용과 관련하여 Riluzole가 CYP1A substrate이라는 점을 통해 대사 경로에서 독성대사체로의 전환 유무에 대한 확인은 좋은 정보를 제공할 것으로 사료된다.
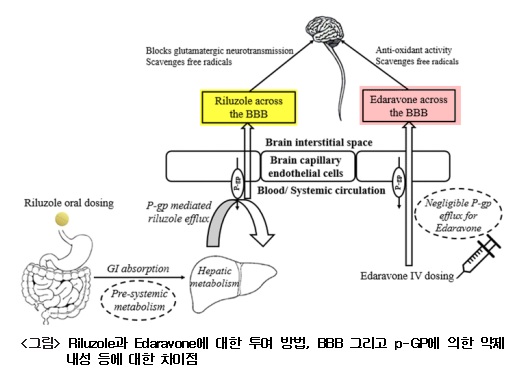
② Edaravone: Edaravone은 TARDBP와 FUS 유전자 돌연변이 확인 후 2015년에 항산화약물(anti-oxidant agent)이다. Edaravone은 ALS 환자의 기능저하를 예방하는 약물의 24주 투여 임상시험에서 투약군과 위약대조군과에서 ALS 기능 평가척도인 ALSFRS-R(Amyotrophic Lateral Sclerosis Functional Rating Scale-Revised)에서 6점 범위에서 2.49 정도가 개선되는 것이 확인되었다( Abe etal., 2017; Zachary et al., 2020). 아래의 <그림>은 Riluzole과 Edaravone에 대한 투여 방법, BBB 그리고 p-GP에 의한 약제내성 등에 대한 차이점을 나타낸 것이다. Riluzole 인 경우 ALS 환자의 근마비 등에 의한 경구투여의 어려움으로 다른 투여 방법이 모색되고 있다(Dash etal., 2018).
4. 결론
○ 필자는 루게릭병이라는 것에 대해 지난 5회 칼럼을 통해 이 질환에 대한 특징을 4가지로 요약할 수 있다.
1. 유전자 결함 및 환경요인의 복학적인 원인이지만 환경 요인도 무시 할 수 없다는 점이다.
2. 병인론으로 추정되는 8가지 원인과 질환의 빠른 진행은 ALS 병인론적 network과 오늘날 약물 개발의 기전적 표적에 있어서 significant Gap을 유발하여 치료제 또는 ALS disease-modifying drug 등의 약물 개발을 어렵게 만든다. 특히 약물로는 운동신경세포의 재생을 유도하지 못하고 현재의 2-3개월 수명 연장에 머물고 있는 ALS disease-modifying drug의 개발에 새로운 접근이 필요하다. 이를 위해서는 무엇보다도 병인론의 단순화를 통한 앞서 언급한 significant gap을 줄이기 위해 가장 우선적으로 oxidative stress와 병인론과의 network를 구축할 필요성이 있다.
3. 왜 이와 같은 접근이 필요한 것일까? ALS 발현이 fALS 또는 sALS의 어느 기전에 의존하여 발생하든지와는 상관이 없이 종국에는 운동신경세포의 apoptosis 및 necrosis에 의한 죽음이며 손상이다. 특히 다음의 ALS에 대한 <정의>와 아래의 <그림>에서처럼 상부운동신경은 대뇌피질, 그리고 하부운동신경은 뇌간과 척수 그리고 종국에는 근육과 연결되어 있다. (ALS 정의: This neurodegenerative disease is characterized by the progressive loss of upper motor neurons in the cerebral cortex and lower motor neurons in the brain stem and spinal cord , leading to muscle weakness, and progressing into muscle atrophy and paralysis, which culminates in respiratory failure and death). 이러한 점은 운동신경세포의 손상에 의한 ALS 발현이 핵심 이론에 의한 설정한 산화적 스트레스의 원천이 반드시 운동신경세포 자체에서 발생하는 것이 아니라 이들과 연결되거나 둘러싸고 있는 spinal cord 등의 주변 환경에서 발생할 수 있다는 점이다. 운동신경세포 자체가 아니고 운동신경세포 주변 또는 전실혈관계로부터 발생한 oxidative stress에 의한 ALS 발생이라면 ALS의 ' the progressive loss' 질환 특성을 고려할 때 예방과 지연 측면에서 새로운 접근이 가능하다는 점이다. 즉, oxidative stress의 원천이 systemic vs connected or surrounding vs in situ에 따라 ALS의 증상의 진행을 늦추는 질병 조절제(disease-modifying drug) 개발에 있어 상당히 유용할 것으로 사료된다. 특히 운동조절신경과 호흡계의 근육에 대한 산화적 스트레스에 대한 독성기전에 대한 이해는 중요하다고 할 수 있다.
4. 따라서 fALS 또는 sALS의 가장 근본적인 원인으로 oxidative stress로 설정하고 ① ALS 발현과 Systemic vs Local vs In situ oxidative stress 와의 관계, ② ALS 발현과 7가지 요인과의 선행적 관계, ③ 유전자 결함과의 관계 등의 3가지 측면에서 Oxidative stress-유도성 ALS 발현에 대한 이해를 위한 접근이 필요하다고 할 수 있다.



